KTRニュース
株式会社KTRへのご依頼・お問合わせは、TEL:072-997-3471、
メール ktr@office.zaq.jp でも受け付けております。
過去配信済みのKTRニュース
 第001回「LD50(エルディーゴジュウ)」について
第001回「LD50(エルディーゴジュウ)」について 第005回「製品の安全性(有害物質について)」
第005回「製品の安全性(有害物質について)」 第013回「環境マネージメントシステム」について
第013回「環境マネージメントシステム」について 第015回「PBB(ピービービー),PBDE(ピービーディーイー)」について
第015回「PBB(ピービービー),PBDE(ピービーディーイー)」について 第025回「化学物質の安全性」について
第025回「化学物質の安全性」について 第030回「有機溶剤(ゆうきようざい)」について
第030回「有機溶剤(ゆうきようざい)」について 第031回「かび」とは何か
第031回「かび」とは何か 第036回「CAS 番号(キャス バンゴウ)」について
第036回「CAS 番号(キャス バンゴウ)」について 第038回「界面活性剤(かいめんかっせいざい)」について
第038回「界面活性剤(かいめんかっせいざい)」について 第040回「化学物質の安全性調査」について
第040回「化学物質の安全性調査」について 第043回「無毒性量(むどくせいりょう)」について
第043回「無毒性量(むどくせいりょう)」について 第046回「環境マーク」について
第046回「環境マーク」について 第051回「放射線の単位」について
第051回「放射線の単位」について 第053回「プラスチックの添加剤(てんかざい)」について
第053回「プラスチックの添加剤(てんかざい)」について 第054回「臭いとVOC(ブイオーシー)」について
第054回「臭いとVOC(ブイオーシー)」について 第068回「EN71-3の規制物質増える」
第068回「EN71-3の規制物質増える」 第074回「エコテック規格100」について
第074回「エコテック規格100」について 第081回「in vitro(イン・ビトロ)とin vivo(イン・ビボ)」について
第081回「in vitro(イン・ビトロ)とin vivo(イン・ビボ)」について 第083回「皮膚感作性(ひふかんさせい)」について
第083回「皮膚感作性(ひふかんさせい)」について 第084回「鉛毒(なまりどく)」について
第084回「鉛毒(なまりどく)」について 第104回「毒」について
第104回「毒」について 第106回「皮膚刺激性」について
第106回「皮膚刺激性」について 第108回「きのこ」について
第108回「きのこ」について 第112回「エコマーク」について
第112回「エコマーク」について 第117回「ワクチン」とは何か
第117回「ワクチン」とは何か 第014回「アクリル」について
第014回「アクリル」について 第024回「ボールタック試験(粘着性の試験)」について
第024回「ボールタック試験(粘着性の試験)」について 第037回「粘着剤」について 1
第037回「粘着剤」について 1 第044回「ゴム」について
第044回「ゴム」について 第056回「粘着テープ関係のJIS規格」について
第056回「粘着テープ関係のJIS規格」について 第058回「ボールタック、粘着力、保持力の関係」について
第058回「ボールタック、粘着力、保持力の関係」について 第063回「超撥水性(ちょうはっすいせい)」について
第063回「超撥水性(ちょうはっすいせい)」について 第075回「粘着剤」について 2
第075回「粘着剤」について 2 第090回「膠(にかわ)」について
第090回「膠(にかわ)」について 第101回「医療用粘着テープ」について
第101回「医療用粘着テープ」について 第109回「布テープの粘着力要素(試料幅、圧着力等の違い等)」について
第109回「布テープの粘着力要素(試料幅、圧着力等の違い等)」について 第111回「離型紙(りけいし)」について
第111回「離型紙(りけいし)」について 第113回「濡(ぬ)れ性(せい)」について
第113回「濡(ぬ)れ性(せい)」について 第006回「分析」について 1
第006回「分析」について 1 第021回「プラスチックの見分け方(赤外分析)」について1
第021回「プラスチックの見分け方(赤外分析)」について1 第027回「蛍光X線分析機」について
第027回「蛍光X線分析機」について 第028回「熱可塑性プラスチックの熱分析」について
第028回「熱可塑性プラスチックの熱分析」について 第041回「周期律表と蛍光X線分析」
第041回「周期律表と蛍光X線分析」 第052回「ガス-マス(GC-MS:ジーシー/マス)分析」について
第052回「ガス-マス(GC-MS:ジーシー/マス)分析」について 第059回「プラスチックの見分け方(赤外分析)」について2
第059回「プラスチックの見分け方(赤外分析)」について2 第060回「赤外分析」について
第060回「赤外分析」について 第067回「赤外線分析(IR)」について
第067回「赤外線分析(IR)」について 第092回「分析」について 2
第092回「分析」について 2 第093回「分析」について 3
第093回「分析」について 3 第119回「粘弾性(ねんだんせい);レオロジー」とは何か
第119回「粘弾性(ねんだんせい);レオロジー」とは何か 第120回「粘弾性(ねんだんせい);レオロジー」とは何か 2
第120回「粘弾性(ねんだんせい);レオロジー」とは何か 2 第002回「ストレスクラック」について
第002回「ストレスクラック」について 第016回「可塑剤(かそざい)」について
第016回「可塑剤(かそざい)」について 第017回「水と油はなぜ混ざらないのか」
第017回「水と油はなぜ混ざらないのか」 第023回「積層造形(ラピッドプロトタイピング)」について
第023回「積層造形(ラピッドプロトタイピング)」について 第032回「製品の耐久試験」について
第032回「製品の耐久試験」について  第035回「色」について
第035回「色」について 第050回「静電気」について
第050回「静電気」について 第055回「ウレタン」について
第055回「ウレタン」について 第057回「シリコン樹脂」について 1
第057回「シリコン樹脂」について 1 第066回「エラストマー」について
第066回「エラストマー」について  第077回「プラスチックの劣化(熱可塑性)」
第077回「プラスチックの劣化(熱可塑性)」 第078回「プラスチックの分子量を測定する」
第078回「プラスチックの分子量を測定する」 第082回「PET(ペット樹脂)」について
第082回「PET(ペット樹脂)」について 第085回「油」について
第085回「油」について 第096回「シリコン樹脂」について 2
第096回「シリコン樹脂」について 2 第107回「ポリビニールアルコール(ポバール)」について
第107回「ポリビニールアルコール(ポバール)」について 第110回「ポリマーアロイ」について
第110回「ポリマーアロイ」について 第115回「ウレタンジェル(耐震マット)」について
第115回「ウレタンジェル(耐震マット)」について 第121回「オレフィン樹脂」について
第121回「オレフィン樹脂」について 第004回「N(ニュートン)」について
第004回「N(ニュートン)」について 第007回「品質工学」(タグチメソッド)について 1
第007回「品質工学」(タグチメソッド)について 1  第008回「品質工学」(タグチメソッド)について 2
第008回「品質工学」(タグチメソッド)について 2  第009回「品質工学」(タグチメソッド)について 3
第009回「品質工学」(タグチメソッド)について 3  第026回「硬さ」について
第026回「硬さ」について 第034回「鉄の錆び」について
第034回「鉄の錆び」について 第039回「抜き取り検査」について
第039回「抜き取り検査」について 第042回「ロードセル(荷重測定器)」について
第042回「ロードセル(荷重測定器)」について 第045回「有限要素法(ゆうげんようそほう)<FEM>」について
第045回「有限要素法(ゆうげんようそほう)<FEM>」について 第061回「メッキ」について
第061回「メッキ」について 第062回「チタン」について
第062回「チタン」について 第065回「CEマーク」について
第065回「CEマーク」について 第069回「鉄(鋼)の焼き入れ」について
第069回「鉄(鋼)の焼き入れ」について 第072回「アルミニュウム」について
第072回「アルミニュウム」について 第076回「JIS(ジス)とは何か」
第076回「JIS(ジス)とは何か」 第089回「ISO(イソ、アイエスオー)」について
第089回「ISO(イソ、アイエスオー)」について 第091回「試験規格」について
第091回「試験規格」について 第094回「アレルギー」について 1
第094回「アレルギー」について 1 第095回「アレルギー」について 2
第095回「アレルギー」について 2 第097回「アレルギー(ゴム)」について 3
第097回「アレルギー(ゴム)」について 3 第098回「繊維製品の物性試験」について
第098回「繊維製品の物性試験」について 第099回「繊維製品の染色堅牢度試験」について
第099回「繊維製品の染色堅牢度試験」について 第100回「防水・耐水・撥水」について
第100回「防水・耐水・撥水」について 第102回「マイクロスコープ」について
第102回「マイクロスコープ」について 第105回「DHAとEPA」について
第105回「DHAとEPA」について 第114回「乳酸菌」について
第114回「乳酸菌」について 第116回「大理石(だいりせき)」について
第116回「大理石(だいりせき)」について 第118回「酵素(こうそ)」とは何か
第118回「酵素(こうそ)」とは何か 第010回「VOC(揮発性有機溶剤)シックハウス症候群」について
第010回「VOC(揮発性有機溶剤)シックハウス症候群」について 第011回「RoHS(ローズ)」について
第011回「RoHS(ローズ)」について 第018回「化審法(かしんほう)」について
第018回「化審法(かしんほう)」について 第020回「HACCP(ハサップ)」食品の安全性確保
第020回「HACCP(ハサップ)」食品の安全性確保 第022回「REACH(リーチ)」とは何か 1
第022回「REACH(リーチ)」とは何か 1 第029回「REACH(リーチ)」とは何か 2
第029回「REACH(リーチ)」とは何か 2 第047回「REACH(リーチ)」とは何か 3
第047回「REACH(リーチ)」とは何か 3 第073回「トスカ(TSCA)」について
第073回「トスカ(TSCA)」について 第086回「化学物質を規制する法律 1」
第086回「化学物質を規制する法律 1」 第087回「化学物質を規制する法律 2」
第087回「化学物質を規制する法律 2」 第088回「化学物質を規制する法律 3」
第088回「化学物質を規制する法律 3」KTRニュース動画
 株式会社KTRのYouTubeページ
株式会社KTRのYouTubeページ
youtube 最新回
youtube 最新回
youtube 動画配信リスト
第002回「ストレスクラック」について
第003回「促進試験」について
第004回「N(ニュートン)」について
第005回「製品の安全性(有害物質)」について
第010回「VOC(揮発性有機溶剤)シックハウス症候群」について
第011回「RoHS(ローズ」について
第012回「安全係数)」について
第013回「環境マネージメントシステム」について
第014回「アクリル」について
第016回「可塑剤」について
第017回「水と油はなぜ混ざらないのか」
第021回「プラスチックの見分け方(赤外分析)」について1
第023回「積層造形(ラピッドプロトタイピング)」について
第024回「ボールタック試験(粘着性の試験)」について
第025回「化学物質の安全性」について
第026回「硬さ」について
第027回「蛍光X線分析機」について
第028回「熱可塑性プラスチックの熱分析」について
第031回「かび」とは何か
第032回「製品の耐久試験」について
第033回「扇風機の寿命は何年か」
第035回「色」
第036回「CAS 番号(キャス バンゴウ)」について
第037回「粘着剤」について 1
第038回「界面活性剤(かいめんかっせいざい)」について
第041回「周期律表と蛍光X線分析」
第043回「無毒性量(むどくせいりょう)」について
第044回「ゴム」について
第046回「環境マーク」について
第048回「耐光試験(たいこうしけん)」について 1
第049回「耐光試験(たいこうしけん)」について 2
第052回「ガスーマス(GC-MS:ジーシー/マス)分析」について
第053回「プラスチックの添加剤」について
第054回「臭いとVOC(ブイオーシー)」について
第056回「粘着テープ関係のJIS規格」について
第058回「ボールタック、粘着力、保持力の関係」について
第059回「プラスチックの見分け方(赤外分析)」について2
第060回「赤外分析」について
第062回「チタン」について
第063回「超撥水性(ちょうはっすいせい)」について
第064回「ポリプロピレン(PP)の劣化」について
第066回「エラストマー」について
第067回「赤外線分析(IR)」について
第068回「EN71-3の規制物質増える」
第070回「ABS樹脂(プラスチック)の劣化」について
第073回「トスカ(TSCA)」について
第075回「粘着剤」について 2
第079回「内部応力(残留応力)」について
第081回「in vitro(イン・ビトロ)とin vivo(イン・ビボ)」について
第083回「皮膚感作性」について
第090回「膠(にかわ)」について
第098回「繊維製品の物性試験」について
第099回「繊維製品の染色堅牢度試験」について
第100回「防水・耐水・撥水」について
第101回「医療用粘着テープ」について
第102回「マイクロスコープ」について
第103回「粘着製品の老化試験」について
第104回「毒」について
第105回「DHAとEPA」について
第106回「皮膚刺激性」について
第107回「ポリビニールアルコール(ポバール)」について
第108回「きのこ」について
第109回「布テープの粘着力要素(試料幅、圧着力等の違い等)」について
第110回「ポリマーアロイ」について
第111回「離型紙(りけいし)」について
第112回「エコマーク」について
第113回「濡(ぬ)れ性(せい)」について
第114回「乳酸菌」について
第115回「ウレタンジェル(耐震マット)」について
第116回「大理石(だいりせき)」について
第117回「ワクチン」とは何か
第118回「酵素(こうそ)」とは何か
第119回「粘弾性(ねんだんせい);レオロジー」とは何か
第120回「粘弾性(ねんだんせい);レオロジー」とは何か 2
第121回「オレフィン樹脂」について
KTRニュース配信お申込み
第41回目
第41回「周期律表と蛍光X線分析」
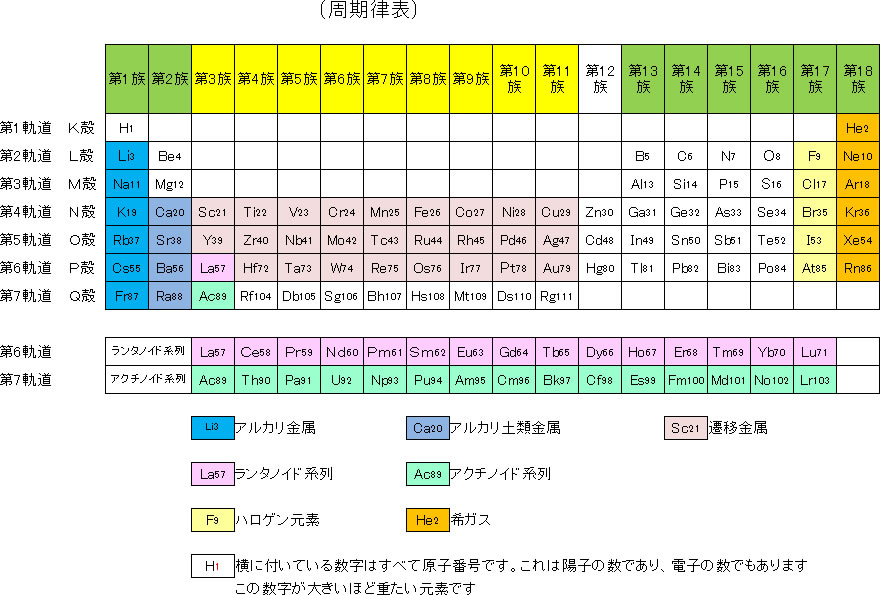
(1)<周期律表>
今回は「周期律表(しゅうきりつひょう)と蛍光X線分析(けいこうえっくすせんぶんせき)」について説明いたします。
蛍光X線分析は、原子の電子の並び方によって原子を特定しようとするものです。原子の電子の並びかたと言えば、周期律表になります。
そこで、周期律表(しゅうきりつひょう)と蛍光X線分析との関係について説明いたします。
まず、周期律表について説明します。周期律表は、英語では、言葉どうり Periodic(周期的) Table(表)と言います。
元素をその重さの順(電子の数順)に並べると、ある周期ごと(8個づつ)に良く似た性質が表れることをメンデレーエフが発見しました。最初の水素とヘリウムは別ですが、その後の元素は8個ごとに良く似た性質の元素が表れます。
これは、元素の一番外側の電子の数によって、原子の性質が決まることを表しています。
下に、代表的な周期律表を表示します。
<< ↑ クリックで別ウィンドウに拡大表示致します。 ↑ >>
(2)<周期律表と蛍光X線分析の関係>
蛍光X線分析とは、原子にX線(エネルギーの高い電磁波です)を照射して、原子から帰ってくるX線を調べることによって、その原子の種類とその量を測定することです。原子にX線を照射して、その原子から反射してくるX線を調べることで、なぜその原子の種類が何であるかが分かるのでしょうか。
簡単にいえば、反射してくる蛍光(反射のこと)X線のエネルギーレベルを調べることで、何の原子か分かるわけです。
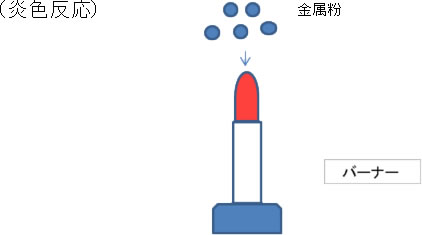
昔、化学の炎色(えんしょく)実験で、バーナーの炎に金属の粉を振りかけると綺麗な色がでたのを覚えている方もおられると思います。
| 銅 | 青緑色 | リチウム | 深紅色 | |
| バリウム | 黄緑色 |
蛍光X線分析も、これと同じことだと考えてください。
バーナーの時は熱を加えて原子にエネルギーを与えて、可視光線を出させたわけですが、蛍光X線分析では、熱よりエネルギーが高いX線を照射して、エネルギーの高い蛍光X線を出させて、それを測定するわけです。
原子を励起させると言いましたが、正確には原子の中の電子にエネルギーを与えて、電子の軌道を上げることです。
エネルギーを与えられて、軌道を変えた(軌道が上にあがる)電子は次にエネルギーを放出して(蛍光X線をだす)元の軌道に戻ります。そのエネルギーの差に相当する蛍光X線をだします。
放出する蛍光X線のことを詳しく知るために、原子の中の電子の状態についてもう少し詳しく知る必要があります。
電子の状態を調べるのに周期律表が必要になります。
(3)<原子の中の電子の状態>
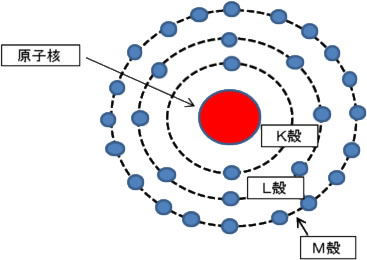
原子モデルとしては、下記のような中心に原子核があり周りを電子が回っているモデルを考える人が多いと思います。それをボーアモデルと言います。
太陽系の中心に太陽があり、周りを水星、金星、地球、火星、木星等の惑星が回っているモデルです。
これは、原子をイメージするには良いモデルなのですが、蛍光X線を理解するには少し単純化しすぎた所があります。
 |
電子 | |
| 内側より、K殻、L殻、M殻と呼びます (A殻より始めるとそれより内側の殻が見つかると困るので、K殻より始めた) |
||
(4)<電子の種類>
原子の中の電子はある一定の軌道の中を非常に速いスピードで動きまわっています。
電子が原子核のまわりの円軌道を周回する、ボーアモデルというのは、少し粗い近似です。
電子は原子核の周りをまわっています。しかし、不規則に回っているわけではなく、一定の軌道を回っています。
軌道の名前一番内側から、
| 殻の名前 | 電子の数 | 電子の累計 | 電子の数の計算式2n2 | ||||
K殻 |
2個 |
2個 |
2×1=2個 | ||||
L殻 |
8個 |
10個 |
2×2×2=8個 | ||||
M殻 |
18個 |
28個 |
2×3×3=18個 | ||||
N殻 |
32個 |
60個 |
2×4×4=32個 | ||||
O殻 |
50個 |
110個 |
2×5×5=50個 | ||||
P殻 |
72個 |
182個 |
2×6×6=72個 | ||||
Q殻 |
98個 |
280個 |
2×7×7=98個 | ||||
と言われる軌道を回っています。
K殻は1つだけ、L殻は3つの副殻に分かれています。M殻は5つの副殻に、N殻は7つの副殻に分かれています。
副殻の形状はs、p、d、fと分かれていて、その形は違います。
K殻には電子が2個ありますが、これは1s軌道だけにあります。
L殻には電子が8個ありますが、すべて同じ軌道にあるのではなく、2s軌道に2個、2px軌道に2個、2py軌道に2個、2pz軌道に2個というふうに分かれて入っています。
M殻は18個の電子がありますが、これはL殻よりさらに複雑で、3s軌道に2個、3px軌道に2個、3py軌道に2個、3pz軌道に2個、3dxy軌道に2個、3dyz軌道に2個、3dzx軌道に2個、3dz2に2個、3dx2-y2軌道に2個というふうに分かれています。M殻は、9個の軌道から出来ています。
殻は内側ほどエネルギーが低いので、通常は一番内側から電子が入って行きます。
しかし、ランタノイド族やアクチノイド族では必ずしも、このとうりではありません。
電子の殻に入る順番
| 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p |
4s軌道は3d軌道より先に入ります。5p軌道や6s軌道は4f軌道より先に電子が入ります。
元素の性格は最も外側の電子の数で決まります。
(原子の中の電子の配列表) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
注:数字は電子の数を表します。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
電子の最外殻に入っている数 この数字が原子の性格を表す |
(5)<電子の性質>
さらに、電子の性質を詳しく説明いたします。
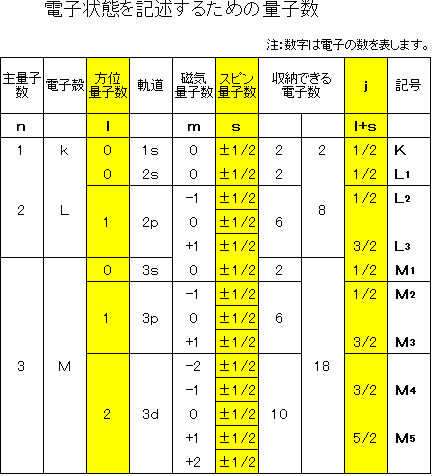
電子のエネルギーレベルは次の4つの量子レベル(特定のとびとびのエネルギーレベル)しか取ることはできません。
| (記号) | ||
| (1)主量子数 | n |
広がりをあらわす 1、2、3、4 |
| (2)方位量子数 | l |
形状をあらわす s、p、d、f |
| (3)磁気量子数 | m |
1つの方位量子数lに対して、(2l+1)個の磁気量子数であらわされる電子の状態が存在し、原子が磁場の中に置かれたとき、わずかにエネルギーの異なる(2l+1)個の順位に分裂する |
| (4)スピン量子数 | s |
電子が回転自転していることに基づく |
1つの原子において、それぞれの電子はこのような4種の量子数で決まるただ1つの状態しかとることができません。
これを、パウリの排他原理と言います。
パウリの排他原理によって、電子はすべての量子数の異なった状態に入っていきます。
多電子原子では、電子のもつエネルギーは主量子数nと方位量子数lによって決まり、そのエネルギー順位は、記号の組合せで表すことができます。
(6)<新しい量子数>
蛍光X線分析のチャート(元素ごとのピークの山が書かれたもの)分析では、さらに詳しい内容が必要になります。
全角運動量子数 j という新たな量子数を導入して、電子の状態を記述する必要があります。
これは電子のスピンベクトルと軌道の角運動ベクトルのカップリング(相互作用)によるもので、以下のベクトル和で表される電子状態です。
| j= l + s |
L殻の電子は電子移動に関して、L1,L2,L3の3つの順位があり、M殻の電子は、M1,M2,M3,M4,M5の5つの順位が存在します。
(7)<蛍光X線のピーク(山)>
蛍光X線分析では、原子の電子にX線を照射して電子を上の殻にあげます。次に上の殻に上がった電子は蛍光X線を放射しながら元の殻に落ちてきます。
K殻から、L殻に上がる場合と、M殻に上がる場合があります。また、L殻からM殻やN殻に上がる場合もあります。
そして、L殻はL1,L2,L3という風に3つに分かれています。M殻はM1,M2,M3,M4,M5という風に5つに分かれています。そして、N殻はN1,N2,N3,N4,N5,N6,N7と言う風に7つに分かれています。
したがって、1つの原子でもいくつものピークがでます。ただ、すべてが同じ大きさのピークにならないので、代表的なピークで原子の種類を決めています。
原子が違えば、他の電子との相互作用で、蛍光X線のエネルギーが違うので、原子の種類の特定が可能になります。
(8)<まとめ>
電子と言っても非常に複雑で、なかなか理解しにくい所があります。蛍光X線分析以外でもICP(アイシーピー)分析とか、原子吸光分析(げんしきゅうこう)とかがあります。これらは基本的には、原子の中の電子の状態を調べるものです。
分析技術の発展が科学の発展の基礎になっています。それと同時に理論的な原子の構造モデルの発展が分析技術の発展につながっています。
分析技術は外からは分かりにくいですが、社会の発展の基礎をになっています。
YouTubeで一部のKTRニュースの動画配信中! 株式会社KTRのYouTubeページ